いよいよ日本でも治験開始のCBD医薬品とは?
- SHARE
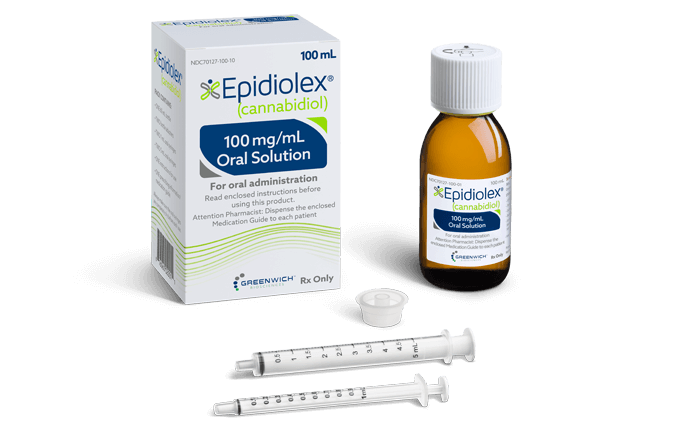
2022年4月21日、CBDを主成分とした医薬品「エピディオレックス」の治験計画がようやく日本で承認されました。
日本のCBD業界にとって大きなこの話について、エピディオレックスの経緯や概要をお伝えします。
シャーロット・フィギの物語
ご存じの方も多いと思いますが、2013年のCNNニュース番組で取り上げられた「シャーロット・フィギの物語」を覚えていらっしゃいますか?
子供の希少型てんかんであるドラべ症候群を患うシャーロットちゃん(享年13歳) は、生まれてわずか3ヶ月後に最初の発作を経験し、5歳になる時には、1週間に300回 を超える激しい発作に苦しんでいました。
医薬品の副作用とともに小さな体は完全に衰弱し、心臓も何度も止まる中、ご両親が藁にもすがる思いで最後の望みをかけたのが大麻由来のCBDオイルでした。
その結果、発作は月2・3回と劇的に減り、他の子供達と同じように普通の生活を送れるようになりました。
この「シャーロット・フィギの物語」や、欧米やアジア諸国の一部で医療大麻が解禁されてきたことを受け、近年、代替治療の可能性に向けて大麻草に含まれる植物性カンナビノイドの研究が世界的に進んでいます。
シャーロットちゃんと同じように難治性てんかんに苦しむお子様をお持ちのご家族は特に、2022年4月21日の吉報に大きな期待を寄せていらっしゃるのではないでしょうか。
この日、日本は、大麻由来の医薬品の使用に道を開くこととなる大きな第一歩を踏み出しました。
CBDを主成分とした医薬品「エピディオレックス」の治験計画がようやく日本でも承認されたのです。
エピディオレックスをめぐる動き
エピディオレックスは、イギリスの製薬会社「GWファーマシューティカルズ」が開発したCBD医薬品です。
アメリカでは、2018年にFDA(米国食品医薬品局)によって、子供の難治性てんかん「レノックス・ガストー症候群」や「ドラベ症候群」の治療薬として承認されました。
日本では現行法の大麻取締法に反するため、エピディオレックスの患者への施用や輸入が不可能となっていますが、治験実現に向けた署名運動も活発化し、国会でもエピディオレックスの国内治験は可能であるとの認識が以前から示されていました。
厚労省では、CBDのニーズを把握しており、ここ数年で大麻取締法の改正に向けた有識者会議も開かれ、今後、部位規制が撤廃されることについても言及しています。
現在、皆さまにお届けしているCBD製品は、大麻草の成熟した茎や種由来であること、THC成分が一切含まれていないこと、医薬品ではないことを条件に輸入販売ができています。
今後、THC成分がゼロであることは変わらず、部位規制をなくして花や葉などからもCBDを抽出することが可能となる法改正のタイミングで、日本でもエピディオレックスが承認されることになるのではないかと予測します。
「大麻」と聞くとマイナスイメージや偏見が生まれてしまうのは、私たちがそのように教育されてきたからでありますが、大麻が正しく理解され、CBDが健康的なライフスタイルを構築するための選択肢となる時代になっていって欲しいと思います。
- この記事をシェア